ジョンソン・エンド・ジョンソン社のCD38抗体Darzalex Fasproを皮下注製剤にFDAが承認しました。

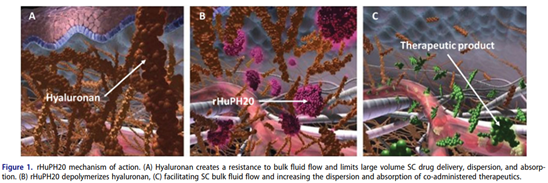
Darzalex Fasproは、ヒアルロン酸がヒトの皮下構造を支える大きな役割を果たし、組換えヒアルロニダーゼ分解により大量の空間を解放し、抗体薬の皮下注入量を増加させるHalozyme社のヒアルロン酸ENHANZE技術を採用しています。
Darzalex Fasproは、1800mg/15mlの投与形態で提供され、また、ヒアルロニダーゼの30,000IUが含まれています。注射時間は、これまでの数時間から3~5分程度に短縮されています。

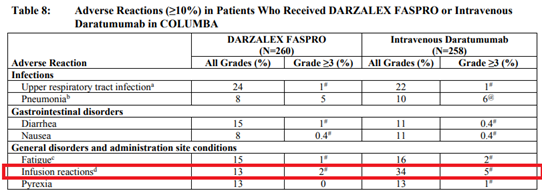
安全性の面では、Darzalex皮下注製剤は従来の静脈内投与製剤と同等の効果が得られ、注射反応は34%から13%と有意に改善しました。
Halozymeのヒアルロニダーゼ技術は、抗体の皮下注射では圧倒的に成功しており、すでにいくつかの抗体医薬の皮下投与形態が市場で承認されています。皮下注射は患者さんのコンプライアンスを大幅に向上させ、病院での静脈注射の医療費も節約できます。
記者 尾尻和紀 報道