記者 尾尻和紀 報道
世界保健機関(WHO)の2018年の統計によると、世界の死亡原因の第2位はがんで、世界では6人に1人近くががんが原因となっています。
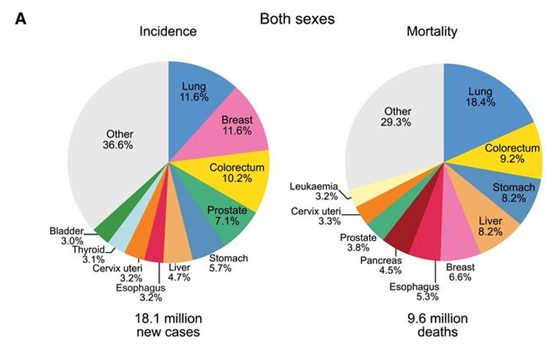
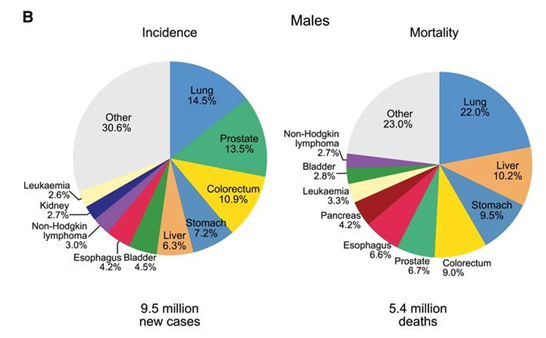
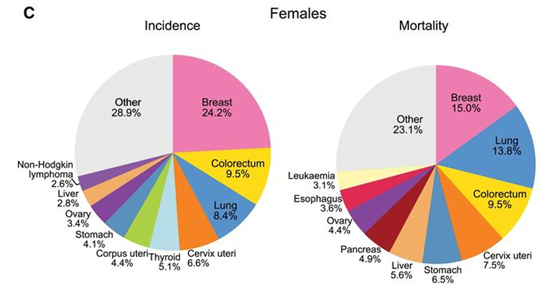
がん分野の世界トップジャーナルである「CA Cancer J Clin」がオンラインで発表した2018年の世界のがん統計によると、肺がんは全がんの11.6%、18.4%を占め、世界のがん罹患原因の第1位となっています。
肺がんの4種類の治療法
肺がんは病理組織学的分類により小細胞型と非小細胞型に分けられますが、その中でも非小細胞肺がん(NSCLC)が圧倒的な割合(80~85%)を占めており、発見時にはすでに中・後期の段階にあるものが多く、5年生存率は非常に低いとされています。
現在、非小細胞肺がん患者さんの臨床治療は、手術、放射線治療、化学療法が主なものとなっています。
しかし、外科的治療に適した患者は20~30%に過ぎず、手術は初期の局所病変にのみ外傷性が高く効果的であるが、不顕性転移には効果がないとされています。放射線治療は局所的な治療法であり、転移性腫瘍の治療には明らかな効果がなく、副作用も大きくなります。
分子研究の発展により、標的治療は肺がん治療のギャップを埋め、患者の予後を大幅に改善することができます。標的治療とは、特定の癌発生部位に対して、対応する薬剤の特異的な結合を設計することで腫瘍細胞のアポトーシスを誘導し、体内の正常細胞へのダメージを防ぎながら、細胞分子レベルでの治療を行うことです。
EGFR遺伝子治療のターゲット
2019年、NCCN(全米包括的がんネットワーク)のガイドラインでは、非小細胞肺がん患者に対して、EGFR、ALK、ROS1、c-MET、BRAF、NTRKなどの標的治療関連遺伝子の検査を行うことが推奨されています。また、これらの特異的な変異部位を標的とした治療薬や個別化治療も徐々に臨床に参入してきており、進行非小細胞肺がんの治療戦略を変えています。
その中でも、非小細胞肺がんの治療標的として初めて発見されたEGFR遺伝子は、最も徹底的に研究されており、臨床的にも成功しています。最近の研究では、アジア太平洋地域とロシアではEGFRが非小細胞肺がんの最も一般的なドライバー遺伝子であり、EGFR変異が非小細胞肺がん患者の49.3%を占めていることが明らかになりました。
EGFR変異のうち、最も一般的な感受性の高い変異は、エキソン19の747-750位のヌクレオチド欠失とエキソン21のL858R変異であり、第一世代EGFR-TKIの使用が考えられる。第2世代EGFR-TKIは、EGFRとHER2標的遺伝子の両方を含んでおり、HER2変異によるEGFR-TKI抵抗性の患者さんに適応があります。
非小細胞肺がん患者は通常、第一世代および第二世代のEGFR-TKI標的薬による8~14ヵ月間の治療後に重大な薬剤耐性を発現し、T790M変異が最も一般的で、患者の約50~60%を占めています。そのため、第三世代EGFR-TKIの開発が加速している。 T790M変異により第1世代または第2世代のEGFR-TKIに対する抵抗性が生じた後、第3世代の治療を行っても7.6ヶ月の生存期間が得られることが研究で示されています。
要するに、進行した肺がんは、人の生命と健康を脅かす重大な脅威であり、患者の家族に大きな経済的・精神的プレッシャーを与えています。
標的療法の発展に伴い、進行非小細胞肺がんの治療戦略も従来の化学療法から個別化された精密治療へと進展しています。しかし、肺がんの発生・進行のメカニズムが深く研究されていることから、近い将来、標的治療によって、より多くの肺がん患者さんのQOLの向上や生存期間の延長が期待できると考えられています。
記者 尾尻和紀 報道