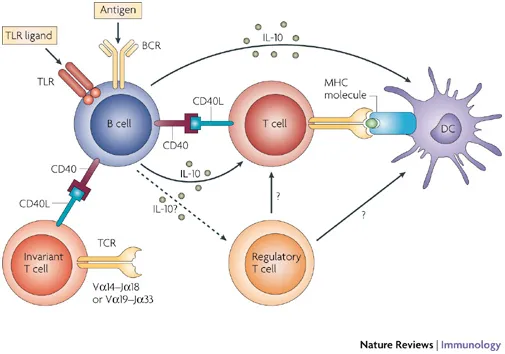
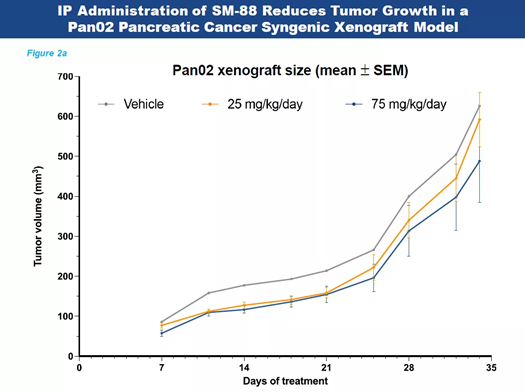
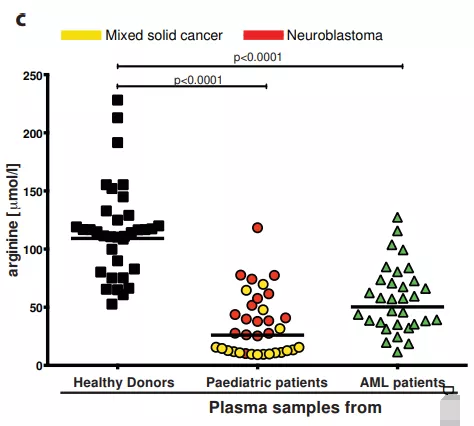
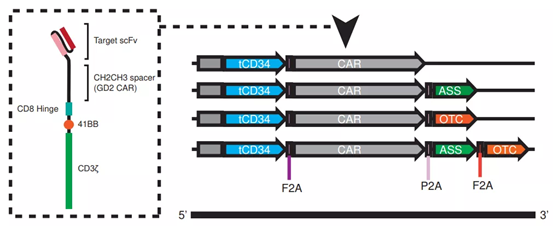
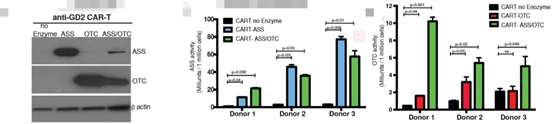
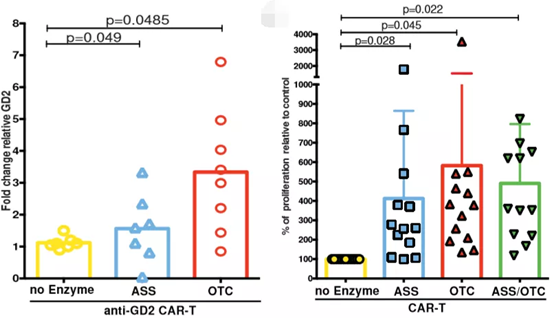
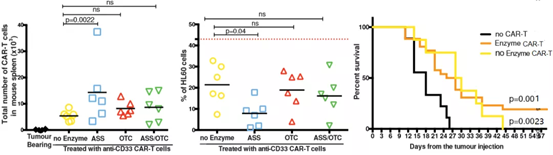
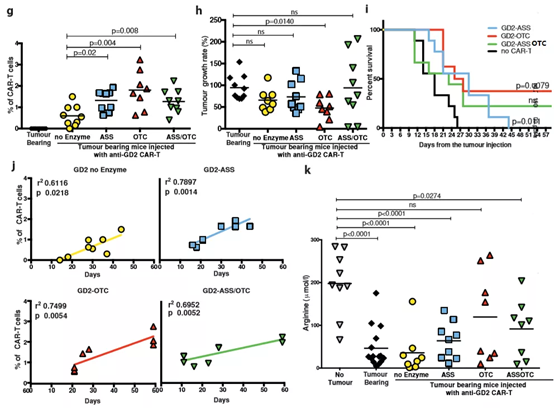
記者 尾尻和紀 報道
ヒューストン大学医学部の研究者たちは、体内のタンパク質が、細胞内の水分やつまらないものの高トン数やアンバランスによる悪影響を軽減する方法を発見しました。
超音波は細胞を収縮させ、最終的には細胞を死滅させます。これらの所見は、脳腫瘍による浮腫、自己免疫疾患、腎障害など様々な疾患に関係している可能性があります。
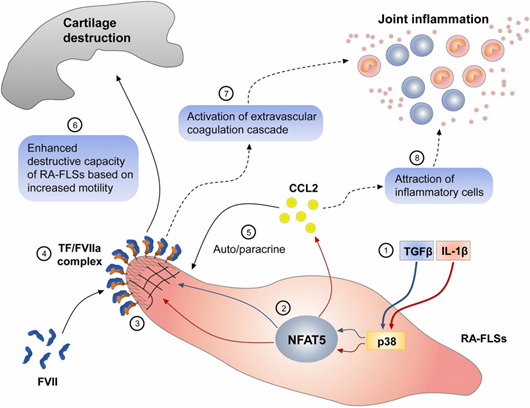
「我々は、活性化されたT細胞の核内因子5(NFAT 5)と呼ばれるこのタンパク質が、特に高トン数に反応して補体を調節するメカニズムを明らかにしました。」と、UH大学医学部の生化学の臨床教授であるRaj Kumar氏は述べています。
NFAT5は、体液量が大きく変動する腎臓などの組織圧の有害な影響から細胞を保護するために重要な役割を果たしています。NFAT5が活性化されると、体液の恒常性に影響を与え、細胞の完全性を維持するのに役立つ小さな可溶化剤である保護浸透圧流体を発現します。Kumar氏は、オスモライトがそこで止まらないことを発見しました。また、共生時にNFAT5を活性化する可能性もあります。
「NFAT5は遺伝子を活性化させるために、浸透液と浸透液がNFAT5に働きかけて構造を与えます。」とKumar氏は述べています。NFAT5遺伝子配列の最初の200アミノ酸は、本質的に秩序があり、構造化されておらず、定義された形状を有していません。Kumar氏は、浸透剤が領域の構造を増加させ、構造化されるとNFAT5は他のタンパク質と相互作用し、そのうちのいくつかは細胞機能の維持に不可欠なものであることを発見しました。
「このタンパク質-タンパク質相互作用は、あらゆる転写因子の自然な機能である。構造化NFAT5と相互作用するタンパク質の1つが高移動度ヒストン(HMGI-C)であり、これはアポトーシスまたはプログラムされた細胞死を阻害することが知られています」とKumar氏は述べています。
水の役割
植物を飼ったことがある人なら、水がいかに生命線にとって重要かを知っているはずです。 意外と知られていませんが、水は人間と同じように細胞の70%を占めています。
人体の70兆個の細胞すべてには、それぞれの細胞が使命を果たし、身体や臓器、組織が正常に機能するためには、水と溶存物質のバランスが必要です。
しかし、植物細胞からの水分補給が植物死につながる場合や、人間の細胞から浸透圧を介して水分が流出すると、細胞が収縮し始めると細胞死が始まるなど、この微妙なバランスが乱れることがあります。
「哺乳類の細胞は、様々な形態のストレスの間に生存率を高める適応応答を持っています。」とKumar氏は言っています。
細胞は、高煙環境による細胞容積の減少を補うために知られている有機オスモライトを蓄積することで、トレブルストレスに適応し、水が細胞内に入ることを可能にします。
このことから、細胞内イオン強度の上昇と透過性の上昇による高トレブルがNFAT5を活性化し、安定化する可能性が高まりました。
記者 尾尻和紀 報道