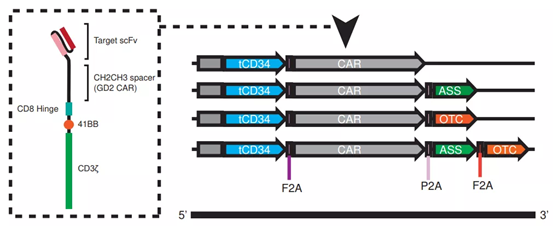
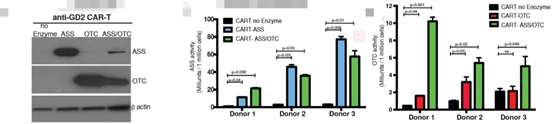
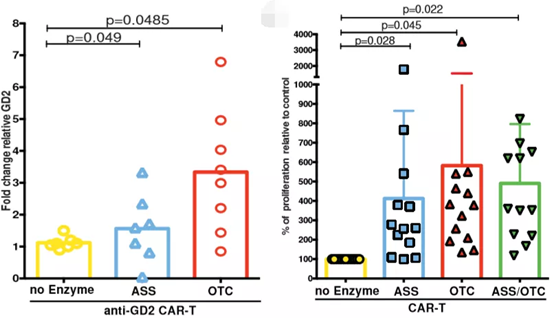
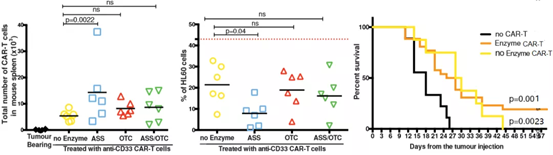
記者 尾尻和紀 報道
Cell Reports誌に掲載された動物実験では、腸内細菌に存在する化学的なシグナルを調べて尿に流すことで、悪い食事の選択に体がどのように反応するかの手がかりが得られる可能性があることが示唆されています。様々な細菌やその他の腸内微生物が、体内の細胞と連動して特定の機能を発揮することや、これらの微生物が薬物の摂取など様々な要因によって影響を受けることが科学界では古くから確立されています。
しかし、最新の研究では、これらの細菌が高脂肪食にどのように反応するかが初めて明らかになりました。

「肥満の原因は、悪い遺伝子や悪い遺伝子が悪い環境と相互作用しているからだと考えがちです。我々の発見は、遺伝的変異がない場合でも、生物の腸内マイクロバイオームが食生活の課題への適応を促進できることを示唆しています。大規模な遺伝学的研究では、個体の生理学的・分子的表現型解析をより深く行う必要があることを強調しています」と上級研究者のDominique Gauguier博士はプレスリリースの中で述べています。
インペリアルカレッジロンドンとパリのINSERM通常市場需要1138の研究者は、遺伝的に類似したラットの尿サンプルをレビューしました。
動物は、食餌を変更する前に、尿サンプル中の腸内細菌が産生する化合物をスクリーニングしました。これは、動物自身の微生物によって産生される代謝物の化学的署名の概要を提供しました。主任研究者のMarc-Emmanuel Dumas博士は、同じ遺伝子構成を持つマウスモデルを使用することで、食生活の変化による変化をゼロにすることができると考えています。研究チームは、食餌を変えた後、動物の化学的特性に大きな変化が見られました。専門家によると、マウスの中には体重が増加したものもあれば、ブドウ糖に対する耐性が低下したものもあったという。研究者によると、化学物質トリメチルアミン-N-オキシド(TMAO)は、耐糖能の特異的な指標となるようだ。
尿サンプルに含まれる特定の化学的特徴は、動物の行動の変化を示唆していると研究者は付け加えました。
研究者たちは、この発見がヒトにとって正しいならば、医療従事者は腸内マイクロバイオームに基づいて患者に最適な個別化された食事を処方することができるかもしれないと考えています。研究者らは、これらの結果はまた、人間の健康全般の改善に効果的な有益な細菌を利用する機会を提供する可能性があると付け加えました。
記者 尾尻和紀 報道