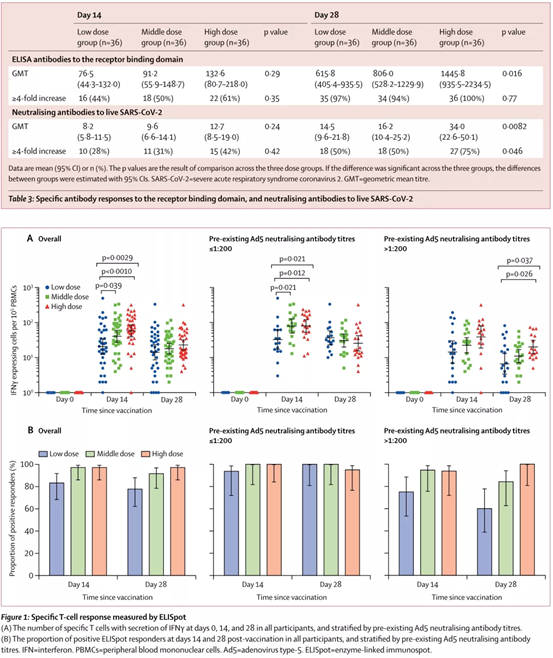
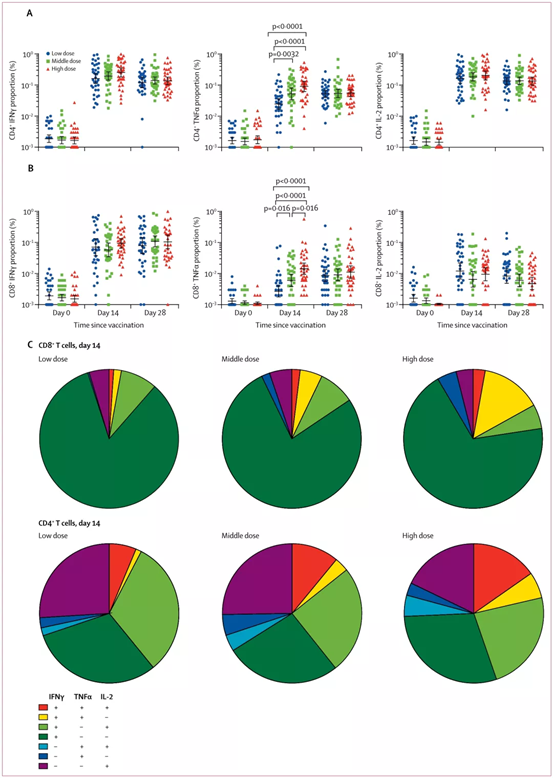
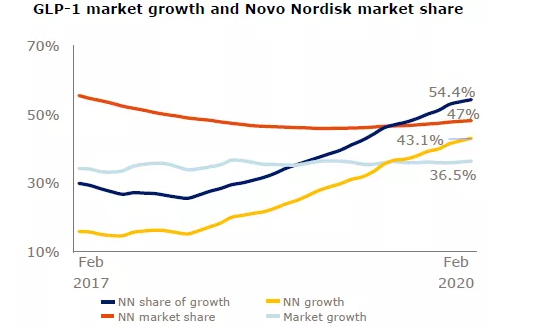
記者 尾尻和紀 報道
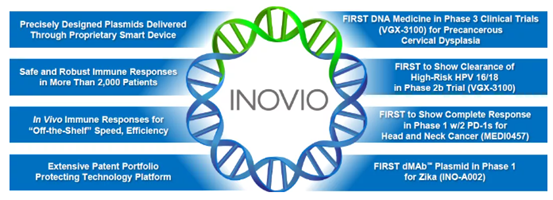
UNC医学部小児科のCamille Ehre助教授の研究室では、呼吸器培養で感染した呼吸器上皮細胞が産生するSARS-CoV-2ウイルス感染型の印象的な画像を作成しました。この作品は、New England Journal of Medicineの「Medical Imaging」に記載されています。
UNCマルシコ肺研究所とUNC小児研究所に所属するEhre氏は、これらの画像を撮影し、気道のSARS-CoV-2感染の強さを非常に鮮やかなグラフィックとわかりやすい画像で説明しました。彼女の研究室は、Ralph Baric PhD、公衆衛生のUNCギリングス学校の疫学のウィリアムR.ケナン特別教授の研究室と共同で研究を実施しました。
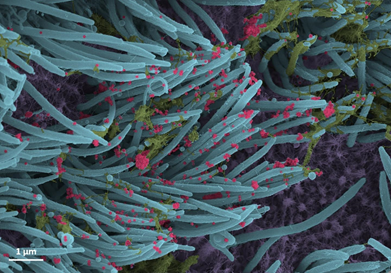
実験室では、SARS-Co-V-2ウイルスをヒト気管支上皮細胞に接種し、96時間後に走査型電子顕微鏡で調べました。
UNCの医学生キャメロン・モリソン氏が再着色した画像には、繊毛の先端(青)に粘液(黄色)が付着した感染した繊毛細胞が写っている。繊毛は、気道上皮細胞の表面にある髪の毛のような構造物で、肺からの粘液(および捕獲されたウイルス)を輸送します。
高出力拡大画像は、気道上皮細胞が産生するSARS-CoV-2ウイルス体(赤色)の構造と密度を示しています。ビロソームは、感染した宿主細胞が呼吸器の表面に放出したウイルスの無傷の感染形態である。
この画像化研究は、ヒト呼吸器系の細胞ごとに産生され、放出されるウイルス粒子の数が異常に多いことを説明するのに役立ちます。大きなウイルス負荷は、感染者の複数の臓器への感染伝達源であり、COVID-19の他者への高頻度感染を媒介している可能性があります。
これらの画像は、感染者と非感染者の両方でSARS-CoV-2の感染を制限するためにマスクを使用するための強力な根拠を提供しています。
記者 尾尻和紀 報道