記者 尾尻和紀 報道
膵臓がんは診断・治療が困難な消化管の悪性度の高い悪性腫瘍で、いくつかの亜型があり、そのうちの90%が膵管腺がん(PDA)です。
近年、膵臓がんの罹患率・死亡率が著しく上昇しており、5年生存率は1%未満であり、予後不良の悪性腫瘍の一つとなっています。膵臓がんは早期診断率が高くなく、手術による死亡率が高い一方で治癒率が低いことから、「がんの王様」とも呼ばれます。膵臓がんは単一のPD-1またはPD-L1阻害剤を用いた腫瘍免疫療法を含む従来の治療法に抵抗することができます。
抗CD40抗体とPD-1/PD-L1阻害薬の併用は、膵管腺がんを含む進行がん患者において臨床的に有望であるが、このような併用の有効性を促進する根本的なメカニズムは明らかにされていません。
最近、米国がん研究協会(AACR)の年次総会では、複数の研究チームが膵臓がんの生存経路を遮断することを目的とした新しい治療戦略を発表しました。ミネソタ大学の研究チームは、PD-L1とCD40を同時にブロックする併用療法に取り組んでいます。
膵臓癌のマウスモデルにおいて、PD-L1またはCD40のいずれかをブロックしますと、有意な抗腫瘍効果と生存期間の延長が得られましたが、最終的なマウスモデルは、膵臓がんが100%再発します。試験の結果、マウスモデルは、MHCクラスIタンパク質とTap1遺伝子の発現に欠陥を持つ腫瘍脱出バリアントを有していました。
研究者たちがCD40とPD-L1の両方をブロックしようとしたところ、膵臓癌マウスモデルの60%が治癒しました。
研究チームはその後、併用療法を受けたマウスモデルの腫瘍の遺伝子発現を調べたところ、併用療法が膵臓がん細胞をクリアするための腫瘍特異的T細胞の蓄積を促進し、腫瘍特異的T細胞の蓄積ががんの再発防止に重要であることを明らかにしたといいます。
PD-1/PD-1L1免疫チェックポイント阻害薬はすでに誰もが知っている薬であり、PD-1/PD-L1を標的とした腫瘍免疫療法では多くの輝かしい成果が得られており、2019年の売上高が111億ドルだったモキサドン開発のPD-1阻害薬「Keytruda」をはじめ、国内外ですでに多くの薬が発売されており、ベストセラー薬トップ10の中では3位にランクインしています。
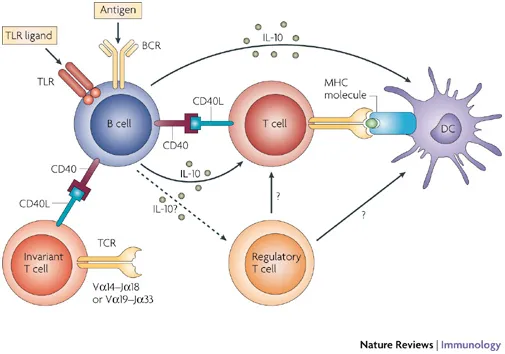
また、CD40、CD27、OX40、GITR、ICOSなどの共刺激性チェックポイントに対するアゴニスティック抗体の開発も急増し始めています。多くの研究で、抗CD40抗体が健康な細胞を傷つけずにがん細胞を効果的に破壊できることが示されており、CD40は抗体医薬開発の人気のターゲットとなっています。
ミネソタ大学のこの研究は、抗CD40抗体+PD-L1遮断が、従来の1型樹状細胞(cCD1s)を促進することで、相乗的にがん細胞を抑制することを示すことで、これまでの知見を拡張したものである。一方、TYME社は、腫瘍の免疫逃避を防ぐために、これまでとは異なる戦略をとっています。タンパク質の合成を変化させることで、酸化ストレスを増加させ、がん細胞の代謝を変化させ、がん細胞の生存を阻害します。
米国がん研究協会(AACR)の年次総会で、TYMEは膵臓がんのマウスモデルでの治療効果を発表しました。その結果、SM-88は酸化ストレスを増加させ、オートファジーなどの重要なプロセスを変化させることで、がん細胞を直接殺すことが示唆されました。さらに、SM-88は免疫調節を誘導するようで、より毒性の強い環境を作り出し、がん細胞の死を誘導します。
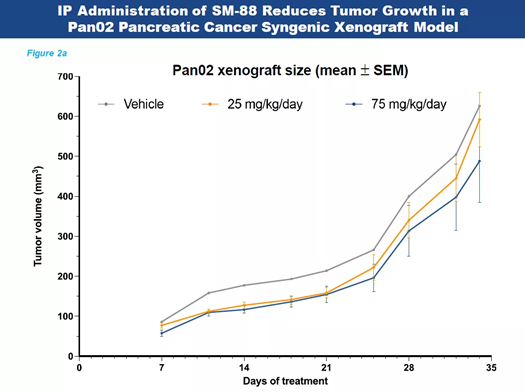
TYMEは、難治性の転移性膵臓がんを対象に、SM-88とシロリムス、フェニトインナトリウム、メチシリンを併用した第2/3相臨床試験を開始しました。
記者 尾尻和紀 報道